EL ALUMINIO.
El aluminio es un elemento químico, de símbolo Al y número atómico 13. Se trata de un metal no ferromagnético. Es el tercer elemento más común encontrado en la corteza terrestre. Los compuestos de aluminio forman el 8% de la corteza de la tierra y se encuentran presentes en la mayoría de las rocas, de la vegetación y de los animales.[1] En estado natural se encuentra en muchos silicatos (feldespatos, plagioclasas y micas). Como metal se extrae únicamente del mineral conocido con el nombre de bauxita, por transformación primero en alúmina mediante el proceso Bayer y a continuación en aluminio metálico mediante electrólisis.
Este metal posee una combinación de propiedades que lo hacen muy útil en ingeniería mecánica, tales como su baja densidad (2.700 kg/m3) y su alta resistencia a la corrosión. Mediante aleaciones adecuadas se puede aumentar sensiblemente su resistencia mecánica (hasta los 690 MPa). Es buen conductor de la electricidad y del calor, se mecaniza con facilidad y es relativamente barato. Por todo ello es desde mediados del siglo XX[2] el metal que más se utiliza después del acero.
Fue aislado por primera vez en 1825 por el físico danés H. C. Oersted. El principal inconveniente para su obtención reside en la elevada cantidad de energía eléctrica que requiere su producción. Este problema se compensa por su bajo coste de reciclado, su dilatada vida útil y la estabilidad de su precio.
CARACTERÍSTICAS QUÍMICAS
Debido a su elevado estado de oxidación se forma rápidamente al aire una fina capa superficial de óxido de aluminio (Alúmina Al2O3) impermeable y adherente que detiene el proceso de oxidación, lo que le proporciona resistencia a la corrosión y durabilidad. Esta capa protectora, de color gris mate, puede ser ampliada por electrólisis en presencia de oxalatos. Ciertas aleaciones de alta dureza presentan problemas graves de corrosión intercristalina.
El aluminio tiene características anfóteras. Esto significa que se disuelve tanto en ácidos (formando sales de aluminio) como en bases fuertes (formando aluminatos con el anión [Al (OH)4]-) liberando hidrógeno.
La capa de óxido formada sobre el aluminio se puede disolver en ácido cítrico formando citrato de aluminio.
El principal y casi único estado de oxidación del aluminio es +III como es de esperarse por sus tres electrones en la capa de valencia (Véase también: metal pesado, electrólisis).
El aluminio reacciona con facilidad con HCl, NaOH, ácido perclórico, pero en general resiste la corrosión debido al óxido. Sin embargo cuando hay iones Cu2+ y Cl- su pasivación desaparece y es muy reactivo.
Los alquilaluminios, usados en la polimerización del etileno,[6] son tan reactivos que destruyen el tejido humano y producen reacciones exotérmicas violentas al contacto del aire y del agua.[7]
El óxido de aluminio es tan estable que se utiliza para obtener otros metales a partir de sus óxidos (cromo, manganeso, etc.) por el proceso aluminotérmico.
COMPUESTOS DEL ALUMINIO
Compuestos no metálicos de aluminio
El óxido de aluminio, también llamado alúmina, (Al2O3) es un producto intermedio de la obtención de aluminio a partir de la bauxita. Se utiliza como revestimiento de protección y como adsorbente para purificar productos químicos. El óxido de aluminio cristalino se llama corindón y se utiliza principalmente como abrasivo. El corindón transparente se llama rubí cuando es rojo y zafiro en los otros casos, utilizándose en joyería y en los emisores de rayos láser. El rubí y el zafiro también pueden ser producidos artificialmente.[9]
Los haluros de aluminio tienen características de ácido Lewis y son utilizados como tales como catalizadores o reactivos auxiliares. En particular, el cloruro de aluminio (AlCl3) se emplea en la producción de pinturas y caucho sintético así como en el refino de petróleo.
Los aluminosilicatos son una clase importante de minerales. Forman parte de las arcillas y son la base de muchas cerámicas y vidrios. En vidrios y cerámicas también se utilizan óxidos de aluminio y el borato de aluminio (Al2O3 · B2O3).
El hidróxido de aluminio (Al (OH)3) se emplea como antiácido, como mordiente, en tratamiento de aguas, en la producción de cerámica y vidrio y en la impermeabilización de tejidos.
Los hidruros complejos de aluminio son reductores valiosos en síntesis orgánica.
El sulfato de aluminio (Al2(SO4)3) y el sulfato de amonio y aluminio (Al (NH4)(SO4)2) se emplean como modiente el tratamiento en el tratamiento de aguas, en la producción de papel, como aditivo alimentario y en el curtido del cuero.[10]
El fosfato de aluminio (AlPO4) se utiliza, junto con otras materias, como deshidratante a alta temperatura.
El borohidruro de aluminio (Al (BH4)3) se añade como aditivo a los combustibles de aviones de reacción.
Las sales de aluminio de los ácidos grasos (por ejemplo el estearato de aluminio) forman parte de la formulación del napalm.
En muchas vacunas, ciertas sales de aluminio realizan la función de adyuvante inmune para ayudar a la proteína de la vacuna a adquirir suficiente potencia para estimular al sistema inmunitario.
El Al (CH2CH3)3 arde violentamente al aire y destruye rápidamente los tejidos.
martes, 14 de diciembre de 2010
El polipropileno.
POLIPROPILENO
El polipropileno es un termoplástico semicristalino, que se produce polimerizando propileno en presencia de un catalizador estereo específico.
El polipropileno tiene múltiples aplicaciones, por lo que es considerado como uno de los productos termoplásticos de mayor desarrollo en el futuro.
Es un producto inerte, totalmente reciclable, su incineración no tiene ningún efecto contaminante, y su tecnología de producción es la de menor impacto ambiental. Esta es una característica atractiva frente a materiales alternativos.
DESCUBRIMIENTO DEL POLIPROPILENO
La polimerización catalítica del propileno fue descubierta por el italiano Giulio Natta en 1954 y marcó un notable hito tanto por su interés científico, como por sus importantes aplicaciones en el ámbito industrial. Empleando catalizadores selectivos, se obtuvo un polímero cristalino formado por la alineación ordenada de moléculas de propileno monómero. Los altos rendimientos de reacción permitieron su rápida explotación comercial. Aunque el polipropileno fue dado a conocer a través de patentes y publicaciones en 1954, su desarrollo comercial comenzó en 1957 y fue debido a la empresa italiana Montecatini. Pocos años más tarde, otras empresas, entre ellas I.C.I. y Shell fabricaban también dicha poliolefina.
Este descubrimiento impulsó la investigación de los sistemas catalíticos estereoespecíficos para la polimerización de olefinas y le otorgó a Natta, junto al alemán Karl Ziegler, el premio Nobel de química en 1963.
ESTRUCTURA DEL POLIPROPILENO
Estructuralmente es un polímero vinílico, similar al polietileno, sólo que uno de los carbonos de la unidad monomérica tiene unido un grupo metilo.
El polipropileno fabricado de manera industrial es un polímero lineal, cuya espina dorsal es una cadena de hidrocarburos saturados. Cada dos átomos de carbono de esta cadena principal, se encuentra ramificado un grupo metilo (CH3). Esto permite distinguir tres formas isómeras del polipropileno:
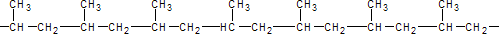
Isotáctica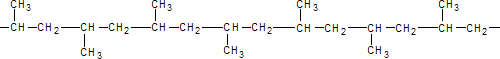
Sindiotáctica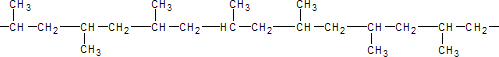
AtácticaEstas se diferencian por la posición de los grupos metilo-CH3 con respecto a la estructura espacial de la cadena del polímero.
El polipropileno es un termoplástico semicristalino, que se produce polimerizando propileno en presencia de un catalizador estereo específico.
El polipropileno tiene múltiples aplicaciones, por lo que es considerado como uno de los productos termoplásticos de mayor desarrollo en el futuro.
Es un producto inerte, totalmente reciclable, su incineración no tiene ningún efecto contaminante, y su tecnología de producción es la de menor impacto ambiental. Esta es una característica atractiva frente a materiales alternativos.
DESCUBRIMIENTO DEL POLIPROPILENO
La polimerización catalítica del propileno fue descubierta por el italiano Giulio Natta en 1954 y marcó un notable hito tanto por su interés científico, como por sus importantes aplicaciones en el ámbito industrial. Empleando catalizadores selectivos, se obtuvo un polímero cristalino formado por la alineación ordenada de moléculas de propileno monómero. Los altos rendimientos de reacción permitieron su rápida explotación comercial. Aunque el polipropileno fue dado a conocer a través de patentes y publicaciones en 1954, su desarrollo comercial comenzó en 1957 y fue debido a la empresa italiana Montecatini. Pocos años más tarde, otras empresas, entre ellas I.C.I. y Shell fabricaban también dicha poliolefina.
Este descubrimiento impulsó la investigación de los sistemas catalíticos estereoespecíficos para la polimerización de olefinas y le otorgó a Natta, junto al alemán Karl Ziegler, el premio Nobel de química en 1963.
ESTRUCTURA DEL POLIPROPILENO
Estructuralmente es un polímero vinílico, similar al polietileno, sólo que uno de los carbonos de la unidad monomérica tiene unido un grupo metilo.
El polipropileno fabricado de manera industrial es un polímero lineal, cuya espina dorsal es una cadena de hidrocarburos saturados. Cada dos átomos de carbono de esta cadena principal, se encuentra ramificado un grupo metilo (CH3). Esto permite distinguir tres formas isómeras del polipropileno:
Isotáctica
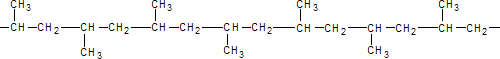
Sindiotáctica
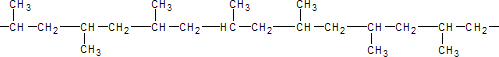
Atáctica
Suscribirse a:
Entradas (Atom)






